دوره 12، شماره 2 - ( 6-1405 )
جلد 12 شماره 2 صفحات 336-320 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Soltani M, Fatahi A, Heidari F. Effects of Vitamin D Supplementation on Achilles Tendon Biomechanics in Healthy Male Wistar Rats. J Sport Biomech 2026; 12 (2) :320-336
URL: http://biomechanics.iauh.ac.ir/article-1-479-fa.html
URL: http://biomechanics.iauh.ac.ir/article-1-479-fa.html
سلطانی محمد، فتاحی علی، حیدری فاطمه. مصرف مکمل ویتامین D تأثیر معنیداری بر سازگاری بیومکانیکی تاندون آشیل در موشهای صحرایی نر ویستار ندارد: یک مطالعه تجربی. مجله بیومکانیک ورزشی. 1405; 12 (2) :320-336
محمد سلطانی1 

 ، علی فتاحی*1
، علی فتاحی*1 

 ، فاطمه حیدری2
، فاطمه حیدری2 




 ، علی فتاحی*1
، علی فتاحی*1 

 ، فاطمه حیدری2
، فاطمه حیدری2 


1- گروه بیومکانیک ورزشی، دانشگاه آزاد اسلامی واحد تهران مرکزی، تهران، ایران.
2- مرکز تحقیقات سلولی و مولکولی، دانشگاه علوم پزشکی قم، قم، ایران.
2- مرکز تحقیقات سلولی و مولکولی، دانشگاه علوم پزشکی قم، قم، ایران.
متن کامل [PDF 1826 kb]
(12 دریافت)
| چکیده (HTML) (24 مشاهده)
متن کامل: (8 مشاهده)
مقدمه
مکملهای غذایی که بهعنوان مواد مغذی یا ترکیباتی که برای افزایش سلامت یا عملکرد فراتر از رژیمهای غذایی معمول مصرف میشوند (1)، تعریف میشوند، بهطور گسترده توسط ورزشکاران و عموم مردم مورد استفاده قرار میگیرند (2, 3). مکملهای غذایی عملکردهای متعددی را در استراتژی عملکرد یک ورزشکار ایفا میکنند، از جمله حفظ سلامت کلی با اطمینان از مصرف کافی مواد مغذی ضروری، رفع کمبود ریزمغذیها و تأمین انرژی و درشت مغذیهایی که ممکن است صرفاً از منابع غذایی به دست آوردن آنها چالشبرانگیز باشد. ورزشکاران اغلب از مکملها برای بهبود مستقیم عملکرد و همچنین مزایای غیرمستقیم مانند پشتیبانی از تمرینات شدید، شکلدهی به ترکیب بدن، تسکین ناراحتیهای اسکلتی عضلانی، تسریع بهبود آسیب و بهبود خلقوخو استفاده میکنند (1, 5, 6).
مصرف مکملها در دو دهه گذشته افزایش یافته و توجه مصرفکنندگان را به خود جلب کرده است (7-9). همزمان، روشهای علمی پیشرفته برای ارزیابی مکملهای غذایی بهطور قابلتوجهی گسترش یافته است. مقالات مختلف، پیشرفت در درک مواد مغذی مانند ویتامین D، آهن، امگا 3 و ید را برجسته میکنند. بااینحال، تحقیقات در مورد ترکیبات گیاهی و غیرمغذی، مانند گلوکزامین، متیل سولفونیل متان (MSM) و کوآنزیم Q10، همچنان چالشبرانگیز است (4, 10, 11). مکملهای غذایی میتوانند شامل کربوهیدراتها، پروتئینها، چربیها، مواد معدنی، ویتامینها، مواد گیاهی، آنزیمها، واسطههای متابولیک (بهعنوان مثال، اسیدهای آمینه خاص) و عصارههای مختلف مشتق شده از گیاهان یا غذاها باشند. این مکملها به سه دسته طبقهبندی میشوند: 1. مکملهایی با پایه نظری قوی و شواهد قابلتوجهی از اثربخشی و ایمنی؛ 2. مکملهایی با منطق علمی معتبر اما شواهد متناقض که نیاز به بررسی بیشتر دارند؛ و 3. مکملهایی که فاقد توجیه معتبر هستند و مطالعات نشاندهنده عدم اثربخشی و خطرات بالقوه آنها است. این طبقهبندی بر نیاز به ارزیابی دقیق ایمنی و اثربخشی مکملهای غذایی تأکید میکند (12).
ویتامین D، یک پیشساز هورمون و پیشساز کلسیتریول، متابولیسم کلسیم و فسفات را تنظیم میکند و از رشد استخوان، سلامت اسکلت و عملکرد عضلات پشتیبانی میکند (13). خواص ضدالتهابی و نقش آن در کاهش خطر شکستگی، ضعف عضلانی و تاندونوپاتی بهخوبی مستند شده است (14, 15). فرم فعال آن، 1α,25-dihydroxyvitamin D₃، با کاهش سیتوکینهای پیشالتهابی (مانند IL-6، TNF-α، IFN-γ) و افزایش IL-10 ضدالتهابی در سلولهای خون انسان آلوده به مایکوباکتریوم توبرکلوزیس، پاسخهای ایمنی را تعدیل میکند (16). ویتامین D همچنین التهاب را از طریق گونههای فعال اکسیژن، فعالیت سیکلواکسیژناز و مسیر NF-κB کنترل میکند (36). مصرف آن عملکرد عصبی عضلانی را بهویژه در بزرگسالان مسن بهبود میبخشد (37) و آسیبهای اسکلتی عضلانی ناشی از تمرینات برونگرا (اکسنتریک) را در ورزشکاران کاهش میدهد (38). ممکن است نقش ضدالتهابی در فرآیندهای پاتوفیزیولوژیکی شامل التهاب داشته باشد (39). ویتامین D اثرات محافظت سلولی در تنوسیتهای آسیبدیده نشان میدهد، تکثیر را افزایش داده و نشانگرهای اختصاصی تاندون را از طریق مسیرهای ERK و p38 MAPK بازیابی میکند و آن را بهعنوان یک درمان بالقوه برای ترمیم تاندون با تعدیل پاسخهای ایمنی و تکثیر سلولی قرار میدهد (17, 18). مصرف این مکمل نویدبخش افزایش قدرت و عملکرد تاندون، بهویژه در گروههای در معرض خطر مانند ورزشکاران و سالمندان است (20). ویتامین D از طریق تأثیر بر سنتز کلاژن، ترکیب ماتریکس خارج سلولی و عملکرد سلولی در بافتهای تاندون، نقش تنظیمی مهمی در بیومکانیک تاندون ایفا میکند (20). ویتامین D با گیرندههای هستهای خاص در تنوسیتها (سلولهای تاندون) تعامل دارد و منجر به افزایش سنتز کلاژن نوع I - یک جزء حیاتی که مسئول استحکام کششی و خاصیت ارتجاعی تاندونها است - میشود. نشان داده شده است که کمبود ویتامین D باعث کاهش سازماندهی کلاژن و تراکم فیبر میشود و در نتیجه باعث کاهش قدرت مکانیکی و حساسیت بیشتر به آسیبهای تاندون میشود (21, 33, 40).
ویتامین D، بهویژه فرم فعال آن 1α,25-dihydroxyvitamin D₃، تمایز سلولهای پیشساز دخیل در بهبود تاندون به استخوان را افزایش میدهد. همچنین با مهار آنزیمهای تجزیهکننده ماتریکس (مانند MMP-9)، کاهش آپوپتوز (مرگ سلولی) و ایجاد یک محیط موضعی بهتر برای ترمیم تاندون، به تعدیل فرآیندهای التهابی کمک میکند (20, 35). مطالعات بالینی نشان میدهد که کمبود ویتامین D با خطر بالاتر تاندونوپاتی و تأخیر در بهبود تاندون در ورزشکاران و بزرگسالان مسنتر مرتبط است. مصرف مکمل و حفظ سطح کافی ویتامین D میتواند خواص بیومکانیکی تاندونها را بهبود بخشد و ممکن است بهبودی پس از آسیبهای تاندون را تسریع کند. نظارت منظم بر سطح ویتامین D و مکملهای مناسب، بهویژه در جمعیتهای پرخطر توصیه میشود (20, 21). بهطور خلاصه، ویتامین D یک عامل قابل اصلاح حیاتی برای سلامت و عملکرد تاندون است که از طریق تأثیر بر فعالیت سلولی و سازماندهی ماتریکس، بر ترکیب بافت و عملکرد بیومکانیکی آن تأثیر میگذارد (19-22).
خواص بیومکانیکی تاندون شامل مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده نشاندهنده ظرفیت عملکردی آن هستند (23). مقاومت مکانیکی بیشینه نشاندهنده استحکام نهایی، سفتی نشاندهنده مقاومت در برابر تغییر شکل، تغییر شکل نشاندهنده خاصیت ارتجاعی و انرژی جذب شده نشاندهنده سختی است (24). این خواص در درجه اول توسط مورفولوژی تاندون، از جمله ساختار سلولی، ترکیب و سازماندهی ماتریکس خارج سلولی و ویژگیهای مولکولی تعیین میشوند. تغییرات میتوانند بهطور قابلتوجهی بر عملکرد مکانیکی تأثیر بگذارند (25-28). تاندون آشیل که برای حرکت ضروری است و بسیار مستعد آسیب است (41)، یک مدل ایدهآل برای مطالعات مکملهای غذایی است. پارامترهایی مانند تغییر شکل و انرژی جذب شده که برای انعطافپذیری حیاتی هستند، بهندرت در زمینههای ویتامین D ارزیابی میشوند (34, 42). مدلهای موش صحرایی بینشهای کنترلشدهای را با پاسخهای متغیر به نوع مکمل ارائه میدهند (24, 31). موش صحرایی ویستار یک استاندارد در تحقیقات بیومکانیکی است (32).
علیرغم ارتباط گسترده بین ویتامین D و سلامت اسکلتی عضلانی، اثرات خاص آن بر بیومکانیک تاندون همچنان ناشناخته مانده است و یافتههای متناقضی در بین جمعیتها (بهعنوان مثال، ورزشکاران در مقابل افراد کمتحرک) و تمرکز محدود فراتر از سفتی یا اندازه (بهعنوان مثال، جذب انرژی) وجود دارد. این مطالعه با بررسی اثرات یک پروتکل 8 هفتهای مصرف مکمل ویتامینD بر بیومکانیک تاندون آشیل در موشهای نر ویستار، این شکاف را برطرف میکند و فرضیه بهبود سفتی، قدرت و انعطافپذیری را مطرح میکند.
روش شناسی
نمونه های مورد پژوهش
در این مطالعه تجربی، 30 سر موش صحرایی نر نژاد ویستار (با سن 2 تا 3 ماه، وزن اولیه 180 تا 230 گرم) از پژوهشگاه رویان در تهران، ایران تهیه شدند. موشها در قفسهای پلیکربنات با دسترسی آزاد به غذا و آب در مرکز حیوانات دانشگاه علوم پزشکی قم (دما: 22 درجه سانتیگراد؛ چرخه روشنایی: تاریکی 12:12 ساعت) نگهداری شدند. به آنها پلتهای استاندارد داده شد. پس از یک هفته سازگاری، موشها بهطور تصادفی به سه گروه (هر گروه 10 سر) کنترل، پارافین (حامل) و ویتامین D تقسیم شدند. مداخله 8 هفته طول کشید. تمام مراحل مطابق با دستورالعملهای اخلاقی مراقبت از حیوانات در دانشگاه علوم پزشکی قم بود و توسط کمیته اخلاق پژوهشگاه تربیتبدنی و علوم ورزشی با کد اخلاق IR.SSRI.REC-2312-2570 تأیید شد.
پروتکل مصرف ویتامین D
ویتامین D₃ بهصورت خوراکی با دوز 500 IU/kg (معادل 5/12 میکروگرم بر کیلوگرم وزن بدن) تجویز شد، در 5/1 میلیگرم بر کیلوگرم پارافین حل شد و به مدت 8 هفته، سه بار در هفته بهصورت گاواژ به موشها خورانده شد (29, 30).
بافتبرداری
تشریح ۲۴ ساعت پس از مداخله انجام شد. موشها با کتامین (۱۰۰ میلیگرم بر کیلوگرم) و زایلازین (۸۰ میلیگرم بر کیلوگرم) بیهوش شدند. پوست روی اندامهای تحتانی برش داده شد و تاندونهای آشیل با دقت و بدون آسیب جدا شدند و در لولههای فالکون برچسبگذاری شده، قرار داده شدند و برای آزمایش کشش به آزمایشگاه بافتشناسی و بیومکانیک دانشگاه علوم پزشکی قم منتقل شدند.
تست کشش
کشش تاندون با استفاده از دستگاه کشش Santam® (ساخت ایران) اندازهگیری شد. تاندونها بین فکهای ثابت و متحرک قرار داده شدند و برای آزمایش کشش تنظیم شدند.
پروتکل اندازهگیری پارامترهای بیومکانیکی
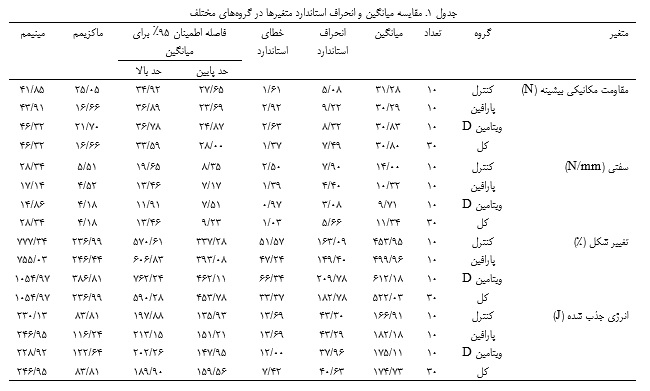
بار اعمال شده تا زمان پارگی و منحنی تنش-کرنش از طریق نرمافزار متصل ثبت شد. پارامترهای بیومکانیکی گزارش شده شامل موارد زیر بودند: مقاومت مکانیکی بیشینه (N): حداکثر تنش قبل از شکست، جایی که نیروی کششی بر مقاومت غلبه میکند و منحنی شیب منفی دارد (23, 43). سفتی (N/mm): شیب منحنی تنش-کرنش در ناحیه الاستیک، نشاندهنده استحکام یا الاستیسیته تاندون (23, 44). تغییر شکل (%): میزان کشیدگی تاندون تحت نیروی کششی (23, 43). انرژی جذب شده (J): مساحت زیر منحنی تنش-کرنش که نشاندهنده حداکثر انرژی جذب شده تا زمان شکست میباشد (23, 44).
تجزیه و تحلیل آماری
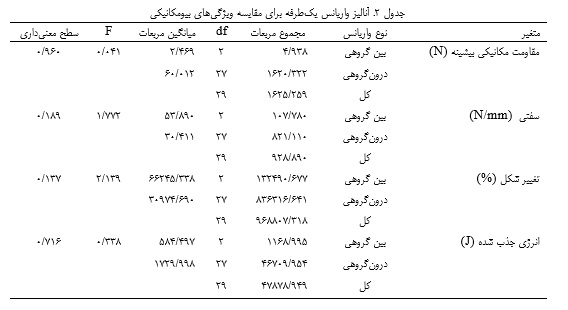
دادهها با استفاده از نرمافزار SPSS تجزیهوتحلیل شدند. آمار توصیفی شامل میانگین و انحراف استاندارد بود. نرمال بودن دادهها با آزمون شاپیرو-ویلک و همگنی واریانسها با آزمون لون ارزیابی شد. اثرات مداخله توسط آزمون تحلیل واریانس یکطرفه با سطح معنیداری 05/0>P بررسی شد.
نتایج
آزمون شاپیرو-ویلک توزیع نرمال دادهها را تأیید کرد و آزمون لون واریانسهای همگن را نشان داد که با فرضیات ANOVA مطابقت داشت. آنالیز واریانس یکطرفه هیچ اثر معنیداری از ویتامین D بر مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده در تاندون آشیل نشان نداد (05/0>P؛ جداول 1 و 2).
مکملهای غذایی که بهعنوان مواد مغذی یا ترکیباتی که برای افزایش سلامت یا عملکرد فراتر از رژیمهای غذایی معمول مصرف میشوند (1)، تعریف میشوند، بهطور گسترده توسط ورزشکاران و عموم مردم مورد استفاده قرار میگیرند (2, 3). مکملهای غذایی عملکردهای متعددی را در استراتژی عملکرد یک ورزشکار ایفا میکنند، از جمله حفظ سلامت کلی با اطمینان از مصرف کافی مواد مغذی ضروری، رفع کمبود ریزمغذیها و تأمین انرژی و درشت مغذیهایی که ممکن است صرفاً از منابع غذایی به دست آوردن آنها چالشبرانگیز باشد. ورزشکاران اغلب از مکملها برای بهبود مستقیم عملکرد و همچنین مزایای غیرمستقیم مانند پشتیبانی از تمرینات شدید، شکلدهی به ترکیب بدن، تسکین ناراحتیهای اسکلتی عضلانی، تسریع بهبود آسیب و بهبود خلقوخو استفاده میکنند (1, 5, 6).
مصرف مکملها در دو دهه گذشته افزایش یافته و توجه مصرفکنندگان را به خود جلب کرده است (7-9). همزمان، روشهای علمی پیشرفته برای ارزیابی مکملهای غذایی بهطور قابلتوجهی گسترش یافته است. مقالات مختلف، پیشرفت در درک مواد مغذی مانند ویتامین D، آهن، امگا 3 و ید را برجسته میکنند. بااینحال، تحقیقات در مورد ترکیبات گیاهی و غیرمغذی، مانند گلوکزامین، متیل سولفونیل متان (MSM) و کوآنزیم Q10، همچنان چالشبرانگیز است (4, 10, 11). مکملهای غذایی میتوانند شامل کربوهیدراتها، پروتئینها، چربیها، مواد معدنی، ویتامینها، مواد گیاهی، آنزیمها، واسطههای متابولیک (بهعنوان مثال، اسیدهای آمینه خاص) و عصارههای مختلف مشتق شده از گیاهان یا غذاها باشند. این مکملها به سه دسته طبقهبندی میشوند: 1. مکملهایی با پایه نظری قوی و شواهد قابلتوجهی از اثربخشی و ایمنی؛ 2. مکملهایی با منطق علمی معتبر اما شواهد متناقض که نیاز به بررسی بیشتر دارند؛ و 3. مکملهایی که فاقد توجیه معتبر هستند و مطالعات نشاندهنده عدم اثربخشی و خطرات بالقوه آنها است. این طبقهبندی بر نیاز به ارزیابی دقیق ایمنی و اثربخشی مکملهای غذایی تأکید میکند (12).
ویتامین D، یک پیشساز هورمون و پیشساز کلسیتریول، متابولیسم کلسیم و فسفات را تنظیم میکند و از رشد استخوان، سلامت اسکلت و عملکرد عضلات پشتیبانی میکند (13). خواص ضدالتهابی و نقش آن در کاهش خطر شکستگی، ضعف عضلانی و تاندونوپاتی بهخوبی مستند شده است (14, 15). فرم فعال آن، 1α,25-dihydroxyvitamin D₃، با کاهش سیتوکینهای پیشالتهابی (مانند IL-6، TNF-α، IFN-γ) و افزایش IL-10 ضدالتهابی در سلولهای خون انسان آلوده به مایکوباکتریوم توبرکلوزیس، پاسخهای ایمنی را تعدیل میکند (16). ویتامین D همچنین التهاب را از طریق گونههای فعال اکسیژن، فعالیت سیکلواکسیژناز و مسیر NF-κB کنترل میکند (36). مصرف آن عملکرد عصبی عضلانی را بهویژه در بزرگسالان مسن بهبود میبخشد (37) و آسیبهای اسکلتی عضلانی ناشی از تمرینات برونگرا (اکسنتریک) را در ورزشکاران کاهش میدهد (38). ممکن است نقش ضدالتهابی در فرآیندهای پاتوفیزیولوژیکی شامل التهاب داشته باشد (39). ویتامین D اثرات محافظت سلولی در تنوسیتهای آسیبدیده نشان میدهد، تکثیر را افزایش داده و نشانگرهای اختصاصی تاندون را از طریق مسیرهای ERK و p38 MAPK بازیابی میکند و آن را بهعنوان یک درمان بالقوه برای ترمیم تاندون با تعدیل پاسخهای ایمنی و تکثیر سلولی قرار میدهد (17, 18). مصرف این مکمل نویدبخش افزایش قدرت و عملکرد تاندون، بهویژه در گروههای در معرض خطر مانند ورزشکاران و سالمندان است (20). ویتامین D از طریق تأثیر بر سنتز کلاژن، ترکیب ماتریکس خارج سلولی و عملکرد سلولی در بافتهای تاندون، نقش تنظیمی مهمی در بیومکانیک تاندون ایفا میکند (20). ویتامین D با گیرندههای هستهای خاص در تنوسیتها (سلولهای تاندون) تعامل دارد و منجر به افزایش سنتز کلاژن نوع I - یک جزء حیاتی که مسئول استحکام کششی و خاصیت ارتجاعی تاندونها است - میشود. نشان داده شده است که کمبود ویتامین D باعث کاهش سازماندهی کلاژن و تراکم فیبر میشود و در نتیجه باعث کاهش قدرت مکانیکی و حساسیت بیشتر به آسیبهای تاندون میشود (21, 33, 40).
ویتامین D، بهویژه فرم فعال آن 1α,25-dihydroxyvitamin D₃، تمایز سلولهای پیشساز دخیل در بهبود تاندون به استخوان را افزایش میدهد. همچنین با مهار آنزیمهای تجزیهکننده ماتریکس (مانند MMP-9)، کاهش آپوپتوز (مرگ سلولی) و ایجاد یک محیط موضعی بهتر برای ترمیم تاندون، به تعدیل فرآیندهای التهابی کمک میکند (20, 35). مطالعات بالینی نشان میدهد که کمبود ویتامین D با خطر بالاتر تاندونوپاتی و تأخیر در بهبود تاندون در ورزشکاران و بزرگسالان مسنتر مرتبط است. مصرف مکمل و حفظ سطح کافی ویتامین D میتواند خواص بیومکانیکی تاندونها را بهبود بخشد و ممکن است بهبودی پس از آسیبهای تاندون را تسریع کند. نظارت منظم بر سطح ویتامین D و مکملهای مناسب، بهویژه در جمعیتهای پرخطر توصیه میشود (20, 21). بهطور خلاصه، ویتامین D یک عامل قابل اصلاح حیاتی برای سلامت و عملکرد تاندون است که از طریق تأثیر بر فعالیت سلولی و سازماندهی ماتریکس، بر ترکیب بافت و عملکرد بیومکانیکی آن تأثیر میگذارد (19-22).
خواص بیومکانیکی تاندون شامل مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده نشاندهنده ظرفیت عملکردی آن هستند (23). مقاومت مکانیکی بیشینه نشاندهنده استحکام نهایی، سفتی نشاندهنده مقاومت در برابر تغییر شکل، تغییر شکل نشاندهنده خاصیت ارتجاعی و انرژی جذب شده نشاندهنده سختی است (24). این خواص در درجه اول توسط مورفولوژی تاندون، از جمله ساختار سلولی، ترکیب و سازماندهی ماتریکس خارج سلولی و ویژگیهای مولکولی تعیین میشوند. تغییرات میتوانند بهطور قابلتوجهی بر عملکرد مکانیکی تأثیر بگذارند (25-28). تاندون آشیل که برای حرکت ضروری است و بسیار مستعد آسیب است (41)، یک مدل ایدهآل برای مطالعات مکملهای غذایی است. پارامترهایی مانند تغییر شکل و انرژی جذب شده که برای انعطافپذیری حیاتی هستند، بهندرت در زمینههای ویتامین D ارزیابی میشوند (34, 42). مدلهای موش صحرایی بینشهای کنترلشدهای را با پاسخهای متغیر به نوع مکمل ارائه میدهند (24, 31). موش صحرایی ویستار یک استاندارد در تحقیقات بیومکانیکی است (32).
علیرغم ارتباط گسترده بین ویتامین D و سلامت اسکلتی عضلانی، اثرات خاص آن بر بیومکانیک تاندون همچنان ناشناخته مانده است و یافتههای متناقضی در بین جمعیتها (بهعنوان مثال، ورزشکاران در مقابل افراد کمتحرک) و تمرکز محدود فراتر از سفتی یا اندازه (بهعنوان مثال، جذب انرژی) وجود دارد. این مطالعه با بررسی اثرات یک پروتکل 8 هفتهای مصرف مکمل ویتامینD بر بیومکانیک تاندون آشیل در موشهای نر ویستار، این شکاف را برطرف میکند و فرضیه بهبود سفتی، قدرت و انعطافپذیری را مطرح میکند.
روش شناسی
نمونه های مورد پژوهش
در این مطالعه تجربی، 30 سر موش صحرایی نر نژاد ویستار (با سن 2 تا 3 ماه، وزن اولیه 180 تا 230 گرم) از پژوهشگاه رویان در تهران، ایران تهیه شدند. موشها در قفسهای پلیکربنات با دسترسی آزاد به غذا و آب در مرکز حیوانات دانشگاه علوم پزشکی قم (دما: 22 درجه سانتیگراد؛ چرخه روشنایی: تاریکی 12:12 ساعت) نگهداری شدند. به آنها پلتهای استاندارد داده شد. پس از یک هفته سازگاری، موشها بهطور تصادفی به سه گروه (هر گروه 10 سر) کنترل، پارافین (حامل) و ویتامین D تقسیم شدند. مداخله 8 هفته طول کشید. تمام مراحل مطابق با دستورالعملهای اخلاقی مراقبت از حیوانات در دانشگاه علوم پزشکی قم بود و توسط کمیته اخلاق پژوهشگاه تربیتبدنی و علوم ورزشی با کد اخلاق IR.SSRI.REC-2312-2570 تأیید شد.
پروتکل مصرف ویتامین D
ویتامین D₃ بهصورت خوراکی با دوز 500 IU/kg (معادل 5/12 میکروگرم بر کیلوگرم وزن بدن) تجویز شد، در 5/1 میلیگرم بر کیلوگرم پارافین حل شد و به مدت 8 هفته، سه بار در هفته بهصورت گاواژ به موشها خورانده شد (29, 30).
بافتبرداری
تشریح ۲۴ ساعت پس از مداخله انجام شد. موشها با کتامین (۱۰۰ میلیگرم بر کیلوگرم) و زایلازین (۸۰ میلیگرم بر کیلوگرم) بیهوش شدند. پوست روی اندامهای تحتانی برش داده شد و تاندونهای آشیل با دقت و بدون آسیب جدا شدند و در لولههای فالکون برچسبگذاری شده، قرار داده شدند و برای آزمایش کشش به آزمایشگاه بافتشناسی و بیومکانیک دانشگاه علوم پزشکی قم منتقل شدند.
تست کشش
کشش تاندون با استفاده از دستگاه کشش Santam® (ساخت ایران) اندازهگیری شد. تاندونها بین فکهای ثابت و متحرک قرار داده شدند و برای آزمایش کشش تنظیم شدند.
پروتکل اندازهگیری پارامترهای بیومکانیکی
بار اعمال شده تا زمان پارگی و منحنی تنش-کرنش از طریق نرمافزار متصل ثبت شد. پارامترهای بیومکانیکی گزارش شده شامل موارد زیر بودند: مقاومت مکانیکی بیشینه (N): حداکثر تنش قبل از شکست، جایی که نیروی کششی بر مقاومت غلبه میکند و منحنی شیب منفی دارد (23, 43). سفتی (N/mm): شیب منحنی تنش-کرنش در ناحیه الاستیک، نشاندهنده استحکام یا الاستیسیته تاندون (23, 44). تغییر شکل (%): میزان کشیدگی تاندون تحت نیروی کششی (23, 43). انرژی جذب شده (J): مساحت زیر منحنی تنش-کرنش که نشاندهنده حداکثر انرژی جذب شده تا زمان شکست میباشد (23, 44).
تجزیه و تحلیل آماری
دادهها با استفاده از نرمافزار SPSS تجزیهوتحلیل شدند. آمار توصیفی شامل میانگین و انحراف استاندارد بود. نرمال بودن دادهها با آزمون شاپیرو-ویلک و همگنی واریانسها با آزمون لون ارزیابی شد. اثرات مداخله توسط آزمون تحلیل واریانس یکطرفه با سطح معنیداری 05/0>P بررسی شد.
نتایج
آزمون شاپیرو-ویلک توزیع نرمال دادهها را تأیید کرد و آزمون لون واریانسهای همگن را نشان داد که با فرضیات ANOVA مطابقت داشت. آنالیز واریانس یکطرفه هیچ اثر معنیداری از ویتامین D بر مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده در تاندون آشیل نشان نداد (05/0>P؛ جداول 1 و 2).


بحث
مطالعه حاضر با هدف تعیین اثرات هشت هفته مکمل خوراکی ویتامین D₃ بر خواص بیومکانیکی تاندون آشیل در موشهای صحرایی نر ویستار سالم انجام شد. علیرغم نقشهای شناختهشده ویتامین D در فیزیولوژی اسکلتی عضلانی و زیستشناسی سلولی تاندون، یافتهها هیچ تفاوت معنیداری را در هیچیک از پارامترهای بیومکانیکی اندازهگیری شده - مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده - بین گروههای کنترل، پارافین و ویتامین D نشان نداد. این نتایج نشان میدهد که در شرایط فیزیولوژیکی طبیعی، مکمل ویتامین D با دوز تجویزشده (500 واحد بینالمللی بر کیلوگرم، سه بار در هفته) تأثیر معنیداری بر رفتار مکانیکی بافت تاندون ندارد.
مقاومت مکانیکی بیشینه
مقاومت مکانیکی بیشینه نشاندهنده استحکام کششی نهایی تاندون - حداکثر باری که یک بافت میتواند قبل از شکست تحمل کند - است و بهعنوان یک شاخص کلیدی از یکپارچگی ساختاری و تراز کلاژن عمل میکند (27). در این مطالعه، میانگین مقادیر مقاومت مکانیکی بیشینه تقریباً در بین گروهها یکسان بود. این عدم تفاوت نشان میدهد که مکمل ویتامین D بر استحکام نهایی تاندون تأثیری نداشته است. یافتههای قابل مقایسهای در مطالعات قبلی شامل مدلهای سالم یا ویتامین D کامل گزارش شده است. سیمونسن و همکاران (1995) و سامر (1987) نشان دادند که استحکام تاندون در درجه اول توسط بارگذاری مکانیکی تعدیل میشود، درحالیکه عوامل غذایی هنگامیکه سطح مواد مغذی پایه کافی است، تأثیر حداقلی دارند (31, 32)؛ بنابراین نتایج فعلی با این مفهوم مطابقت دارد که ویتامین D بهعنوان یک عامل مجاز و نه یک عامل تقویتکننده در تنظیم استحکام تاندون عمل میکند. برعکس، آنجلین و همکاران (2014) دریافتند که کمبود ویتامین D بهطور قابلتوجهی مقاومت مکانیکی بیشینه را کاهش داده و باعث اختلال در بهبود تاندون در مدلهای ترمیم روتاتور کاف میشود (33)، درحالیکه مین و همکاران (2019) در شرایط آزمایشگاهی نشان دادند که ویتامین D سنتز کلاژن I و تکثیر تنوسیتها را بازیابی میکند (17). این اختلافات احتمالاً ناشی از تفاوت در وضعیت اولیه ویتامین D، وجود آسیب بافتی و شرایط آزمایشگاهی است. یافتههای فعلی نشان میدهد که مصرف مکمل در غیاب کمبود یا آسیب، استحکام کششی را فراتر از ظرفیت فیزیولوژیکی طبیعی افزایش نمیدهد.
سفتی
سفتی تاندون نشاندهنده مقاومت آن در برابر کشیدگی تحت بار است و کارایی انتقال نیرو را در حین حرکت تعیین میکند (28). مطالعه حاضر هیچ تغییر معنیداری در سفتی نشان نداد. سفتی کمی پایینتر در گروه ویتامین D، اگرچه از نظر آماری ناچیز بود، اما میتواند نشاندهنده تغییرات کوچک و از نظر بیولوژیکی نامربوط در هیدراتاسیون ماتریکس خارج سلولی یا پیوند عرضی کلاژن باشد.
مطالعات قبلی نتایج متفاوتی را گزارش کردهاند. کوبو و همکاران (2001) مشاهده کردند که سفتی تاندون پس از مداخلات کوتاهمدت تغییر معنیداری نداشت، مگر اینکه با بارگذاری مکانیکی با شدت بالا یا مزمن همراه باشد که از نتایج فعلی پشتیبانی میکند (34). برعکس، تارانتینو و همکاران (2024) و دوگرتی و همکاران (2016) افزایش سنتز کلاژن و کاهش فعالیت متالوپروتئیناز ماتریکس (MMP-9) را در پاسخ به ویتامین D توصیف کردند که از نظر تئوری سفتی را افزایش میدهد (20, 35). بااینحال، این اثرات در درجه اول در شرایط کمبود یا پاتولوژیک مشاهده شدند که نشان میدهد مکملها بهتنهایی در بافت سالم برای القای بازسازی بیومکانیکی قابل اندازهگیری، کافی نیستند.
تغییر شکل
تغییر شکل، درصد کشیدگی تاندون قبل از پارگی را نشان میدهد که نشاندهنده خاصیت ارتجاعی و توانایی آن در تحمل فشار مکانیکی است (39). اگرچه میانگین تغییر شکل در گروه ویتامینD در مقایسه با گروههای کنترل و پارافین بیشترین بود، اما این تفاوت از نظر آماری معنیدار نبود. این روند صعودی جزئی ممکن است نشاندهنده افزایش جزئی در انطباق یا رفتار ویسکوالاستیک باشد، اما عدم تغییر در سختی یا حداکثر نیرو، احتمالاً نشاندهنده تغییرپذیری بیولوژیکی طبیعی است تا یک پاسخ انطباقی واقعی.
نتایج قابل مقایسه توسط هوانگ و همکاران (2004) گزارش شد که مشاهده کردند مداخلات تطبیقی یا تغذیهای خفیف در تاندونهای موش صحرایی، بدون تغییرات متناظر در الگوهای بارگذاری کششی، تغییر شکل را بهطور قابلتوجهی تغییر نمیدهد (24). در مقابل، گوان و همکاران (2022) کاهش تغییر شکل پس از مداخله ویتامین D در یک مدل تاندون مبتلا به پوکی استخوان را گزارش کردند که نشاندهنده افزایش یکپارچگی ساختاری است (21). این نتایج متناقض بیشتر تأکید میکنند که تأثیر بیومکانیکی ویتامین D به وضعیت اولیه بافت در شرایط کمبود یا آسیب بستگی دارد، اما در شرایط سالم و با تغذیه مناسب خنثی است.
انرژی جذب شده
انرژی جذبشده یا استحکام، کل انرژی است که یک تاندون میتواند قبل از شکست جذب کند و نشاندهنده مقاومت آن در برابر فشار مکانیکی است (44). در این مطالعه، انرژی جذبشده بین گروهها تفاوت معنیداری نداشت. این نشان میدهد که مکمل، ظرفیت تاندون را برای اتلاف انرژی مکانیکی تغییر نداده است که بیشتر از بیطرفی کلی بیومکانیکی مکمل ویتامین D در این زمینه پشتیبانی میکند. پژوهشهای قبلی در مدلهای حیوانی از این نتایج پشتیبانی میکند. سیمونسن و همکاران (1995) گزارش دادند که استحکام تاندون در موشها پایدار میماند، مگر اینکه در معرض اضافه بار مکانیکی طولانیمدت یا بازسازی پاتولوژیک قرار گیرند (32). از سوی دیگر، مین و همکاران (2019) و کیم و همکاران (2022) پیشنهاد کردند که ویتامین D یکپارچگی ماتریکس خارج سلولی را افزایش میدهد که ممکن است استحکام را در سطح سلولی افزایش دهد (17, 18). هوانگ و همکاران (2004) و سامر (1987) تأیید کردند که تغییرات در انرژی جذب شده در موشهای سالم، بیشتر توسط شدت تمرین و میزان بارگذاری کنترل میشود تا مکملهای غذایی (24, 31). بااینحال، تبدیل تغییرات مولکولی یا بافتی به تفاوتهای مکانیکی قابلاندازهگیری، نیازمند دورههای مداخله طولانیتر یا وجود آسیب ساختاری است و در کمبود یا آسیب، ویتامین D ممکن است با تعدیل جهتگیری کلاژن و مولکولهای اتصال آب در ماتریکس، خواص میرایی مکانیکی را بازیابی کند (20, 33). عدم وجود اثرات قابلتوجه در تمام پارامترهای اندازهگیری شده - مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده- نشان میدهد که مکمل ویتامین D هیچ مزیت مکانیکی افزایشی در تاندونهای سالم و طبیعی ندارد. این نتایج نشان میدهد که تأثیر بیومکانیکی ویتامین D احتمالاً مشروط است و در درجه اول تحت کمبود یا آسیب بافتی ظاهر میشود، جایی که التهاب، سنتز کلاژن و تکثیر سلولی را تعدیل میکند (20, 35). در مقابل، در حیواناتی که دارای سطح کافی ویتامین D هستند، به نظر میرسد که خواص ساختاری و عملکردی تاندون به یک سطح ثابت میرسد که فراتر از آن ویتامین D اضافی، هیچ افزایش قابل اندازهگیری ارائه نمیدهد.
در خصوص محدودیتهای مطالعه، ملاحظات روششناختی متعددی باید در نظر گرفته شود. سطح سرمی 25(OH)D اندازهگیری نشد که مانع از تأیید وضعیت اولیه ویتامین D و اثربخشی درمان میشود. مدت زمان مداخله (8 هفته) و دفعات تجویز ممکن است برای ایجاد بازسازی ساختاری قابل تشخیص کافی نبوده باشد (20, 45, 46). تجزیهوتحلیلهای بافتشناسی و مولکولی (بهعنوان مثال، نسبتهای کلاژن I/III، بیان MMP) انجام نشد که میتوانست تغییرات ریز سلولی غیرقابل تشخیص از طریق آزمایش کشش را نشان دهد (47, 48). نمونه فقط جنس نر (49) و حذف پروتکل اثرات نرخ کرنش (23) تعمیمپذیری را محدود میکند. عدم بارگذاری مکانیکی یا تمرین - که بهعنوان یک محرک قوی سازگاری تاندون شناخته میشود - ممکن است پتانسیل ویتامین D را برای اعمال اثرات سینرژیک محدود کرده باشد (31, 34). تحقیقات آینده باید دوزهای بالاتر، مدت زمان طولانیتر یا مدلهای کمبود را آزمایش کنند و ویتامین D را با تمرین یا سایر مکملها (مثلاً امگا 3) برای همافزایی ترکیب کنند (20, 45, 46, 50, 51). گنجاندن زنان در این مطالعه میتواند تفاوتهای جنسیتی را آشکار کند (49)، درحالیکه بافتشناسی و سنجشهای مولکولی (مثلاً TGF-β1) مکانیسمها را روشن میکنند (48). تصویربرداری پیشرفته یا نمونههای انسانی میتواند شکافها را پر کند (52).
نتیجه گیری نهایی
هشت هفته مصرف مکمل ویتامین D، بیومکانیک تاندون آشیل را در موشهای نر ویستار تغییر نداد که نشاندهنده اثرات محدود در مدلهای سالم است. کمبود ویتامین D ممکن است بهطور برجستهتری تاندونها را مختل کند، درحالیکه مکمل در حالتهای کافی، حداقل بهبود بیومکانیکی را به همراه دارد. مطالعات آینده باید دوز/مدت زمان را تغییر دهند، کمبود را در نظر بگیرند، همافزایی با ورزش یا مکملها (مانند کلسیم، امگا ۳) را بررسی کنند و تفاوتهای جنسیتی را برای اطلاعرسانی در مورد استراتژیهای سلامت تاندون ارزیابی کنند؛ بنابراین حفظ سطح کافی ویتامین D برای سلامت تاندون ضروری است، اما به نظر نمیرسد مکملهای فوق فیزیولوژیکی در تاندونهای طبیعی و بدون کمبود، مزیت بیشتری داشته باشند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با رعایت موازین اخلاق پژوهشی انجام گرفته و پروتکل این مطالعه توسط کمیته اخلاق کمیته اخلاق پژوهشگاه تربیتبدنی و علوم ورزشی با کد اخلاق IR.SSRI.REC-2312-2570 تأیید شده است.
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمان های دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان بهطور مساوی در تهیه مقاله مشارکت داشتهاند.
تعارض
بنا بر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
مطالعه حاضر با هدف تعیین اثرات هشت هفته مکمل خوراکی ویتامین D₃ بر خواص بیومکانیکی تاندون آشیل در موشهای صحرایی نر ویستار سالم انجام شد. علیرغم نقشهای شناختهشده ویتامین D در فیزیولوژی اسکلتی عضلانی و زیستشناسی سلولی تاندون، یافتهها هیچ تفاوت معنیداری را در هیچیک از پارامترهای بیومکانیکی اندازهگیری شده - مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده - بین گروههای کنترل، پارافین و ویتامین D نشان نداد. این نتایج نشان میدهد که در شرایط فیزیولوژیکی طبیعی، مکمل ویتامین D با دوز تجویزشده (500 واحد بینالمللی بر کیلوگرم، سه بار در هفته) تأثیر معنیداری بر رفتار مکانیکی بافت تاندون ندارد.
مقاومت مکانیکی بیشینه
مقاومت مکانیکی بیشینه نشاندهنده استحکام کششی نهایی تاندون - حداکثر باری که یک بافت میتواند قبل از شکست تحمل کند - است و بهعنوان یک شاخص کلیدی از یکپارچگی ساختاری و تراز کلاژن عمل میکند (27). در این مطالعه، میانگین مقادیر مقاومت مکانیکی بیشینه تقریباً در بین گروهها یکسان بود. این عدم تفاوت نشان میدهد که مکمل ویتامین D بر استحکام نهایی تاندون تأثیری نداشته است. یافتههای قابل مقایسهای در مطالعات قبلی شامل مدلهای سالم یا ویتامین D کامل گزارش شده است. سیمونسن و همکاران (1995) و سامر (1987) نشان دادند که استحکام تاندون در درجه اول توسط بارگذاری مکانیکی تعدیل میشود، درحالیکه عوامل غذایی هنگامیکه سطح مواد مغذی پایه کافی است، تأثیر حداقلی دارند (31, 32)؛ بنابراین نتایج فعلی با این مفهوم مطابقت دارد که ویتامین D بهعنوان یک عامل مجاز و نه یک عامل تقویتکننده در تنظیم استحکام تاندون عمل میکند. برعکس، آنجلین و همکاران (2014) دریافتند که کمبود ویتامین D بهطور قابلتوجهی مقاومت مکانیکی بیشینه را کاهش داده و باعث اختلال در بهبود تاندون در مدلهای ترمیم روتاتور کاف میشود (33)، درحالیکه مین و همکاران (2019) در شرایط آزمایشگاهی نشان دادند که ویتامین D سنتز کلاژن I و تکثیر تنوسیتها را بازیابی میکند (17). این اختلافات احتمالاً ناشی از تفاوت در وضعیت اولیه ویتامین D، وجود آسیب بافتی و شرایط آزمایشگاهی است. یافتههای فعلی نشان میدهد که مصرف مکمل در غیاب کمبود یا آسیب، استحکام کششی را فراتر از ظرفیت فیزیولوژیکی طبیعی افزایش نمیدهد.
سفتی
سفتی تاندون نشاندهنده مقاومت آن در برابر کشیدگی تحت بار است و کارایی انتقال نیرو را در حین حرکت تعیین میکند (28). مطالعه حاضر هیچ تغییر معنیداری در سفتی نشان نداد. سفتی کمی پایینتر در گروه ویتامین D، اگرچه از نظر آماری ناچیز بود، اما میتواند نشاندهنده تغییرات کوچک و از نظر بیولوژیکی نامربوط در هیدراتاسیون ماتریکس خارج سلولی یا پیوند عرضی کلاژن باشد.
مطالعات قبلی نتایج متفاوتی را گزارش کردهاند. کوبو و همکاران (2001) مشاهده کردند که سفتی تاندون پس از مداخلات کوتاهمدت تغییر معنیداری نداشت، مگر اینکه با بارگذاری مکانیکی با شدت بالا یا مزمن همراه باشد که از نتایج فعلی پشتیبانی میکند (34). برعکس، تارانتینو و همکاران (2024) و دوگرتی و همکاران (2016) افزایش سنتز کلاژن و کاهش فعالیت متالوپروتئیناز ماتریکس (MMP-9) را در پاسخ به ویتامین D توصیف کردند که از نظر تئوری سفتی را افزایش میدهد (20, 35). بااینحال، این اثرات در درجه اول در شرایط کمبود یا پاتولوژیک مشاهده شدند که نشان میدهد مکملها بهتنهایی در بافت سالم برای القای بازسازی بیومکانیکی قابل اندازهگیری، کافی نیستند.
تغییر شکل
تغییر شکل، درصد کشیدگی تاندون قبل از پارگی را نشان میدهد که نشاندهنده خاصیت ارتجاعی و توانایی آن در تحمل فشار مکانیکی است (39). اگرچه میانگین تغییر شکل در گروه ویتامینD در مقایسه با گروههای کنترل و پارافین بیشترین بود، اما این تفاوت از نظر آماری معنیدار نبود. این روند صعودی جزئی ممکن است نشاندهنده افزایش جزئی در انطباق یا رفتار ویسکوالاستیک باشد، اما عدم تغییر در سختی یا حداکثر نیرو، احتمالاً نشاندهنده تغییرپذیری بیولوژیکی طبیعی است تا یک پاسخ انطباقی واقعی.
نتایج قابل مقایسه توسط هوانگ و همکاران (2004) گزارش شد که مشاهده کردند مداخلات تطبیقی یا تغذیهای خفیف در تاندونهای موش صحرایی، بدون تغییرات متناظر در الگوهای بارگذاری کششی، تغییر شکل را بهطور قابلتوجهی تغییر نمیدهد (24). در مقابل، گوان و همکاران (2022) کاهش تغییر شکل پس از مداخله ویتامین D در یک مدل تاندون مبتلا به پوکی استخوان را گزارش کردند که نشاندهنده افزایش یکپارچگی ساختاری است (21). این نتایج متناقض بیشتر تأکید میکنند که تأثیر بیومکانیکی ویتامین D به وضعیت اولیه بافت در شرایط کمبود یا آسیب بستگی دارد، اما در شرایط سالم و با تغذیه مناسب خنثی است.
انرژی جذب شده
انرژی جذبشده یا استحکام، کل انرژی است که یک تاندون میتواند قبل از شکست جذب کند و نشاندهنده مقاومت آن در برابر فشار مکانیکی است (44). در این مطالعه، انرژی جذبشده بین گروهها تفاوت معنیداری نداشت. این نشان میدهد که مکمل، ظرفیت تاندون را برای اتلاف انرژی مکانیکی تغییر نداده است که بیشتر از بیطرفی کلی بیومکانیکی مکمل ویتامین D در این زمینه پشتیبانی میکند. پژوهشهای قبلی در مدلهای حیوانی از این نتایج پشتیبانی میکند. سیمونسن و همکاران (1995) گزارش دادند که استحکام تاندون در موشها پایدار میماند، مگر اینکه در معرض اضافه بار مکانیکی طولانیمدت یا بازسازی پاتولوژیک قرار گیرند (32). از سوی دیگر، مین و همکاران (2019) و کیم و همکاران (2022) پیشنهاد کردند که ویتامین D یکپارچگی ماتریکس خارج سلولی را افزایش میدهد که ممکن است استحکام را در سطح سلولی افزایش دهد (17, 18). هوانگ و همکاران (2004) و سامر (1987) تأیید کردند که تغییرات در انرژی جذب شده در موشهای سالم، بیشتر توسط شدت تمرین و میزان بارگذاری کنترل میشود تا مکملهای غذایی (24, 31). بااینحال، تبدیل تغییرات مولکولی یا بافتی به تفاوتهای مکانیکی قابلاندازهگیری، نیازمند دورههای مداخله طولانیتر یا وجود آسیب ساختاری است و در کمبود یا آسیب، ویتامین D ممکن است با تعدیل جهتگیری کلاژن و مولکولهای اتصال آب در ماتریکس، خواص میرایی مکانیکی را بازیابی کند (20, 33). عدم وجود اثرات قابلتوجه در تمام پارامترهای اندازهگیری شده - مقاومت مکانیکی بیشینه، سفتی، تغییر شکل و انرژی جذب شده- نشان میدهد که مکمل ویتامین D هیچ مزیت مکانیکی افزایشی در تاندونهای سالم و طبیعی ندارد. این نتایج نشان میدهد که تأثیر بیومکانیکی ویتامین D احتمالاً مشروط است و در درجه اول تحت کمبود یا آسیب بافتی ظاهر میشود، جایی که التهاب، سنتز کلاژن و تکثیر سلولی را تعدیل میکند (20, 35). در مقابل، در حیواناتی که دارای سطح کافی ویتامین D هستند، به نظر میرسد که خواص ساختاری و عملکردی تاندون به یک سطح ثابت میرسد که فراتر از آن ویتامین D اضافی، هیچ افزایش قابل اندازهگیری ارائه نمیدهد.
در خصوص محدودیتهای مطالعه، ملاحظات روششناختی متعددی باید در نظر گرفته شود. سطح سرمی 25(OH)D اندازهگیری نشد که مانع از تأیید وضعیت اولیه ویتامین D و اثربخشی درمان میشود. مدت زمان مداخله (8 هفته) و دفعات تجویز ممکن است برای ایجاد بازسازی ساختاری قابل تشخیص کافی نبوده باشد (20, 45, 46). تجزیهوتحلیلهای بافتشناسی و مولکولی (بهعنوان مثال، نسبتهای کلاژن I/III، بیان MMP) انجام نشد که میتوانست تغییرات ریز سلولی غیرقابل تشخیص از طریق آزمایش کشش را نشان دهد (47, 48). نمونه فقط جنس نر (49) و حذف پروتکل اثرات نرخ کرنش (23) تعمیمپذیری را محدود میکند. عدم بارگذاری مکانیکی یا تمرین - که بهعنوان یک محرک قوی سازگاری تاندون شناخته میشود - ممکن است پتانسیل ویتامین D را برای اعمال اثرات سینرژیک محدود کرده باشد (31, 34). تحقیقات آینده باید دوزهای بالاتر، مدت زمان طولانیتر یا مدلهای کمبود را آزمایش کنند و ویتامین D را با تمرین یا سایر مکملها (مثلاً امگا 3) برای همافزایی ترکیب کنند (20, 45, 46, 50, 51). گنجاندن زنان در این مطالعه میتواند تفاوتهای جنسیتی را آشکار کند (49)، درحالیکه بافتشناسی و سنجشهای مولکولی (مثلاً TGF-β1) مکانیسمها را روشن میکنند (48). تصویربرداری پیشرفته یا نمونههای انسانی میتواند شکافها را پر کند (52).
نتیجه گیری نهایی
هشت هفته مصرف مکمل ویتامین D، بیومکانیک تاندون آشیل را در موشهای نر ویستار تغییر نداد که نشاندهنده اثرات محدود در مدلهای سالم است. کمبود ویتامین D ممکن است بهطور برجستهتری تاندونها را مختل کند، درحالیکه مکمل در حالتهای کافی، حداقل بهبود بیومکانیکی را به همراه دارد. مطالعات آینده باید دوز/مدت زمان را تغییر دهند، کمبود را در نظر بگیرند، همافزایی با ورزش یا مکملها (مانند کلسیم، امگا ۳) را بررسی کنند و تفاوتهای جنسیتی را برای اطلاعرسانی در مورد استراتژیهای سلامت تاندون ارزیابی کنند؛ بنابراین حفظ سطح کافی ویتامین D برای سلامت تاندون ضروری است، اما به نظر نمیرسد مکملهای فوق فیزیولوژیکی در تاندونهای طبیعی و بدون کمبود، مزیت بیشتری داشته باشند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با رعایت موازین اخلاق پژوهشی انجام گرفته و پروتکل این مطالعه توسط کمیته اخلاق کمیته اخلاق پژوهشگاه تربیتبدنی و علوم ورزشی با کد اخلاق IR.SSRI.REC-2312-2570 تأیید شده است.
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمان های دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
همه نویسندگان بهطور مساوی در تهیه مقاله مشارکت داشتهاند.
تعارض
بنا بر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
فهرست منابع
1. Maughan RJ, Burke LM, Dvorak J, Larson-Meyer DE, Peeling P, Phillips SM, et al. IOC consensus statement: dietary supplements and the high-performance athlete. British Journal of Sports Medicine. 2018;52(7):439-55. [DOI:10.1136/bjsports-2018-099027]
2. Wardenaar F, van den Dool R, Ceelen I, Witkamp R, Mensink M. Self-reported use and reasons among the general population for using sports nutrition products and dietary supplements. Sports. 2016;4(2):33. [DOI:10.3390/sports4020033]
3. Hijlkema A, Roozenboom C, Mensink M, Zwerver J. The impact of nutrition on tendon health and tendinopathy: a systematic review. Journal of the International Society of Sports Nutrition. 2022;19(1):474-504. [DOI:10.1080/15502783.2022.2104130]
4. Almasi J, Shabazbigian MM. The effect of six weeks of high-intensity interval training with and without coenzyme Q10 supplementation on bench press and squat strength in competitive male bodybuilders. Journal of Sport Biomechanics. 2025;11(1):80-92. [DOI:10.61186/JSportBiomech.11.1.80]
5. Bailey RL, Gahche JJ, Lentino CV, Dwyer JT, Engel JS, Thomas PR, et al. Dietary supplement use in the United States, 2003-2006. The Journal of Nutrition. 2011;141(2):261-6. [DOI:10.3945/jn.110.133025]
6. Fennell D. Determinants of supplement usage. Preventive Medicine. 2004;39(5):932-9. [DOI:10.1016/j.ypmed.2004.03.031]
7. Kantor ED, Rehm CD, Du M, White E, Giovannucci EL. Trends in dietary supplement use among US adults from 1999-2012. JAMA. 2016;316(14):1464-74. [DOI:10.1001/jama.2016.14403]
8. Marik PE, Flemmer M. Do dietary supplements have beneficial health effects in industrialized nations: what is the evidence? Journal of Parenteral and Enteral Nutrition. 2012;36(2):159-68. [DOI:10.1177/0148607111416485]
9. Manson JE, Brannon PM, Rosen CJ, Taylor CL. Vitamin D deficiency-is there really a pandemic? The New England Journal of Medicine. 2016;375(19):1817-20. [DOI:10.1056/NEJMp1608005]
10. Balentine DA, Dwyer JT, Erdman JW Jr, Ferruzzi MG, Gaine PC, Harnly JM, et al. Recommendations on reporting requirements for flavonoids in research. The American Journal of Clinical Nutrition. 2015;101(6):1113-25. [DOI:10.3945/ajcn.113.071274]
11. Dwyer JT, Coates PM, Smith MJ. Dietary supplements: regulatory challenges and research resources. Nutrients. 2018;10(1):41. [DOI:10.3390/nu10010041]
12. Kerksick CM, Wilborn CD, Roberts MD, Smith-Ryan A, Kleiner SM, Jäger R, et al. ISSN exercise & sports nutrition review update: research & recommendations. Journal of the International Society of Sports Nutrition. 2018;15(1):38. [DOI:10.1186/s12970-018-0242-y]
13. Jeon SM, Shin EA. Exploring vitamin D metabolism and function in cancer. Experimental & Molecular Medicine. 2018;50(4):1-14. [DOI:10.1038/s12276-018-0038-9]
14. Wintermeyer E, Ihle C, Ehnert S, Stöckle U, Ochs G, de Zwart P, et al. Crucial role of vitamin D in the musculoskeletal system. Nutrients. 2016;8(6):319. [DOI:10.3390/nu8060319]
15. Millar NL, Murrell GAC, McInnes IB. Inflammatory mechanisms in tendinopathy-towards translation. Nature Reviews Rheumatology. 2017;13(2):110-22. [DOI:10.1038/nrrheum.2016.213]
16. Khoo AL, Chai LYA, Koenen HJPM, Oosting M, Steinmeyer A, Zuegel U, et al. Vitamin D(3) down-regulates proinflammatory cytokine response to Mycobacterium tuberculosis through pattern recognition receptors while inducing protective cathelicidin production. Cytokine. 2011;55(2):294-300. [DOI:10.1016/j.cyto.2011.04.016]
17. Min K, Lee JM, Kim MJ, Jung SY, Kim KS, Lee S, et al. Restoration of cellular proliferation and characteristics of human tenocytes by vitamin D. Journal of Orthopaedic Research. 2019;37(10):2241-8. [DOI:10.1002/jor.24352]
18. Kim DS, Kim JH, Baek SW, Lee JK, Park SY, Choi B, et al. Controlled vitamin D delivery with injectable hyaluronic acid-based hydrogel for restoration of tendinopathy. Journal of Tissue Engineering. 2022;13:20417314221122089. [DOI:10.1177/20417314221122089]
19. Soltani M, Fatahi A, Yousefian Molla R. The effect of increasing running speed on three-dimensional changes of lower limb joint angles in open motor chain and swing phase. Journal of Sport Biomechanics. 2022;8(3):232-46. [DOI:10.61186/JSportBiomech.8.3.232]
20. Tarantino D, Mottola R, Sirico F, Corrado B, Ruosi C, Saggini R, et al. Exploring the impact of vitamin D on tendon health: a comprehensive review. Journal of Basic and Clinical Physiology and Pharmacology. 2024;35(3):143-52. [DOI:10.1515/jbcpp-2024-0061]
21. Guan Z, Liu S, Luo L, Zhang Q, Tao K. The role of vitamin D on rotator cuff tear with osteoporosis. Frontiers in Endocrinology. 2022;13. [DOI:10.3389/fendo.2022.847401]
22. Mohammad Zaheri R, Majlesi M, Fatahi A. Impact of lower-limb fatigue on kinetic risk factors for ACL injury during post-spike landings in volleyball athletes. Journal of Sport Biomechanics. 2026;11(4):466-84. [DOI:10.61882/JSportBiomech.11.4.466]
23. Buschmann J, Bürgisser GM. Biomechanics of tendons and ligaments: tissue reconstruction and regeneration. Woodhead Publishing; 2017. [DOI:10.1016/B978-0-08-100489-0.00003-X]
24. Huang TF, Perry SM, Soslowsky LJ. The effect of overuse activity on Achilles tendon in an animal model: a biomechanical study. Annals of Biomedical Engineering. 2004;32(3):336-41. [DOI:10.1023/B:ABME.0000017537.26426.76]
25. Shamsehkohan P, Sadeghi H. Overview of the mechanical function of tissue cells affecting human movement. Journal of Rehabilitation Medicine. 2016;5(4):271-81.
26. Peterson DR, Bronzino JD. Biomechanics: principles and applications. 2nd ed. CRC Press; 2007. [DOI:10.1201/9781420008197]
27. Theret DP, Levesque MJ, Sato M, Nerem RM, Wheeler LT. The application of a homogeneous half-space model in the analysis of endothelial cell micropipette measurements. Journal of Biomechanical Engineering. 1988;110(3):190-9. [DOI:10.1115/1.3108430]
28. Mohammad Pour Koli M, Fatahi A. Modern approaches in sport biomechanics: a review paper. Journal of Sport Biomechanics. 2024;9(4):284-300. [DOI:10.61186/JSportBiomech.9.4.284]
29. Nourozi A, Shariati M. Protective effect of vitamin D on spermatogenesis and testicular tissue changes in adult rats treated with thioacetamide. Alborz Health. 2020;9(2):107. [DOI:10.29252/aums.9.2.107]
30. Mehdipoor M, Damirchi A, Razavi Tousi SMT, Babaei P. Concurrent vitamin D supplementation and exercise training improve cardiac fibrosis via TGF-β/Smad signaling in myocardial infarction model of rats. Journal of Physiology and Biochemistry. 2021;77(1):75-84. [DOI:10.1007/s13105-020-00778-6]
31. Sommer HM. The biomechanical and metabolic effects of a running regime on the Achilles tendon in the rat. International Orthopaedics. 1987;11(1):71-5. [DOI:10.1007/BF00266061]
32. Simonsen EB, Klitgaard H, Bojsen-Møller F. The influence of strength training, swim training and ageing on the Achilles tendon and m. soleus of the rat. Journal of Sports Sciences. 1995;13(4):291-5. [DOI:10.1080/02640419508732242]
33. Angeline ME, Ma R, Pascual-Garrido C, Voigt C, Deng XH, Warren RF, et al. Effect of diet-induced vitamin D deficiency on rotator cuff healing in a rat model. The American Journal of Sports Medicine. 2014;42(1):27-34. [DOI:10.1177/0363546513505421]
34. Kubo K, Kanehisa H, Fukunaga T. Effects of different duration isometric contractions on tendon elasticity in human quadriceps muscles. The Journal of Physiology. 2001;536(Pt 2):649-55. [DOI:10.1111/j.1469-7793.2001.0649c.xd]
35. Dougherty KA, Dilisio MF, Agrawal DK. Vitamin D and the immunomodulation of rotator cuff injury. Journal of Inflammation Research. 2016;9:123-31. [DOI:10.2147/JIR.S106206]
36. Chen J, Tang Z, Slominski AT, Li W, Żmijewski MA, Liu Y, et al. Vitamin D and its analogs as anticancer and anti-inflammatory agents. European Journal of Medicinal Chemistry. 2020;207:112738. [DOI:10.1016/j.ejmech.2020.112738]
37. Dhesi JK, Jackson SHD, Bearne LM, Moniz C, Hurley MV, Swift CG, et al. Vitamin D supplementation improves neuromuscular function in older people who fall. Age and Ageing. 2004;33(6):589-95. [DOI:10.1093/ageing/afh209]
38. Żebrowska A, Sadowska-Krępa E, Stanula A, Waśkiewicz Z, Łakomy O, Bezuglov E, et al. The effect of vitamin D supplementation on serum total 25(OH) levels and biochemical markers of skeletal muscles in runners. Journal of the International Society of Sports Nutrition. 2020;17(1):18. [DOI:10.1186/s12970-020-00347-8]
39. Barker T, Henriksen VT, Rogers VE, Aguirre D, Trawick RH, Lynn Rasmussen G, et al. Vitamin D deficiency associates with γ-tocopherol and quadriceps weakness but not inflammatory cytokines in subjects with knee osteoarthritis. Redox Biology. 2014;2:466-74. [DOI:10.1016/j.redox.2014.01.024]
40. Schwartz Z, Schlader DL, Ramirez V, Kennedy MB, Boyan BD. Effects of vitamin D metabolites on collagen production and cell proliferation of growth zone and resting zone cartilage cells in vitro. Journal of Bone and Mineral Research. 1989;4(2):199-207. [DOI:10.1002/jbmr.5650040211]
41. Ulreich N, Kainberger F, Huber W, Nehrer S. Die Achillessehne im Sport. Der Radiologe. 2002;42:811-7. [DOI:10.1007/s00117-002-0800-8]
42. Nourissat G, Houard X, Sellam J, Duprez D, Berenbaum F. Use of autologous growth factors in aging tendon and chronic tendinopathy. Frontiers in Bioscience (Elite Edition). 2013;5(3):911-21. [DOI:10.2741/E670]
43. Oatis CA. Kinesiology: the mechanics and pathomechanics of human movement. Lippincott Williams & Wilkins; 2009.
44. Hamill J, Knutzen K, Derrick T. Biomechanical basis of human movement. 4th ed. Wolters Kluwer Health; 2015.
45. Chel V, Wijnhoven HAH, Smit JH, Ooms M, Lips P. Efficacy of different doses and time intervals of oral vitamin D supplementation with or without calcium in elderly nursing home residents. Osteoporosis International. 2008;19(5):663-71. [DOI:10.1007/s00198-007-0538-2]
46. Zittermann A, Trummer C, Theiler-Schwetz V, Pilz S. Long-term supplementation with 3200 to 4000 IU of vitamin D daily and adverse events: a systematic review and meta-analysis of randomized controlled trials. European Journal of Nutrition. 2023;62(4):1833-44. [DOI:10.1007/s00394-023-03124-w]
47. Langberg H, Skovgaard D, Petersen LJ, Bülow J, Kjær M. Type I collagen synthesis and degradation in peritendinous tissue after exercise determined by microdialysis in humans. The Journal of Physiology. 1999;521(Pt 1):299-306. [DOI:10.1111/j.1469-7793.1999.00299.x]
48. Heinemeier K, Langberg H, Olesen JL, Kjær M. Role of TGF-β1 in relation to exercise-induced type I collagen synthesis in human tendinous tissue. Journal of Applied Physiology. 2003;95(6):2390-7. [DOI:10.1152/japplphysiol.00403.2003]
49. Koenen K, Knepper I, Klodt M, Osterberg A, Stratos I, Mittlmeier T, et al. Sprint interval training induces a sexual dimorphism but does not improve peak bone mass in young and healthy mice. Scientific Reports. 2017;7:44047. [DOI:10.1038/srep44047]
50. Kubo K, Kanehisa H, Fukunaga T. Effects of resistance and stretching training programmes on the viscoelastic properties of human tendon structures in vivo. The Journal of Physiology. 2002;538(Pt 1):219-26. [DOI:10.1113/jphysiol.2001.012703]
51. Woo SL, Gomez MA, Amiel D, Ritter MA, Gelberman RH, Akeson WH. The effects of exercise on the biomechanical and biochemical properties of swine digital flexor tendons. Journal of Biomechanical Engineering. 1981;103(1):51-6. [DOI:10.1115/1.3138246]
52. Magnusson SP, Kjær M. Region-specific differences in Achilles tendon cross-sectional area in runners and non-runners. European Journal of Applied Physiology. 2003;90(5-6):549-53. [DOI:10.1007/s00421-003-0865-8]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





